CNRS LE JOURNAL, MARS 2023
Depuis quelques années, ces micro-organismes suscitent beaucoup d’intérêt de la part des chimistes. Objectif : étudier les bactéries sous un nouvel angle avec la perspective de développer de nouvelles solutions thérapeutiques.
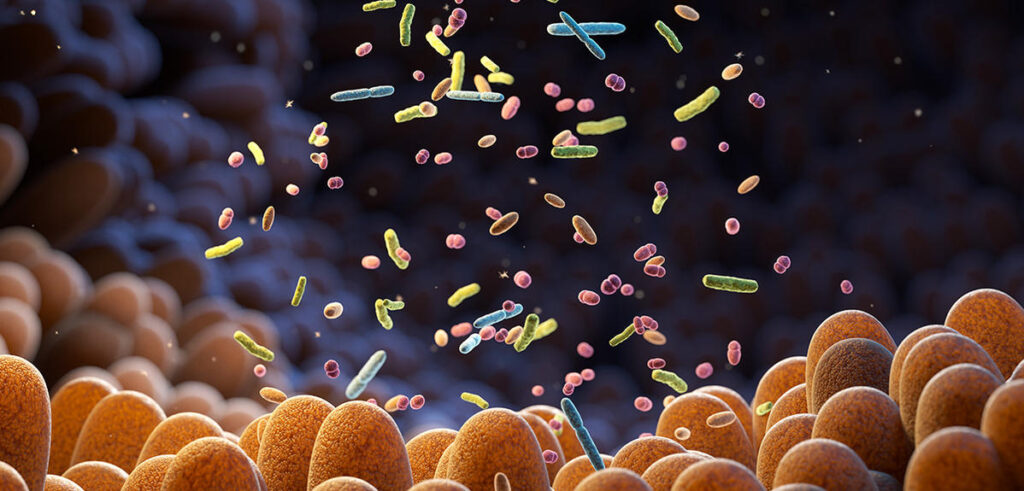
Des cheminées hydrothermales qui jalonnent le fond des océans aux sols perpétuellement gelés d’Alaska ou de Sibérie, jusqu’à notre propre système digestif, aucun milieu n’échappe à la colonisation des bactéries. Malgré leur taille microscopique, ces organismes pèsent d’ailleurs de tout leur poids dans la balance du vivant. Des chercheurs américains ont calculé que l’ensemble des bactéries présentes sur Terre représentait une masse totale de 70 milliards de tonnes de carbone1. (Les scientifiques ont privilégié cette unité de mesure car elle est indépendante du contenu en eau des êtres vivants, qui varie beaucoup d’une espèce à l’autre, Ndlr.) Après les végétaux, les bactéries constituent ainsi le deuxième groupe d’êtres vivants en termes de biomasse.
Si ces organismes unicellulaires aux capacités d’adaptation exceptionnelles intriguent toujours autant les microbiologistes, ils suscitent désormais la curiosité des chimistes qui cherchent à concevoir de nouveaux médicaments. Victor Duarte, du Laboratoire de chimie et biologie des métaux2 (LCBM) à Grenoble, fait partie de ces précurseurs. Avec d’autres chercheurs de l’Institut des sciences moléculaires de Marseille3 et de l’Institut de microbiologie de la Méditerranée4, le biochimiste a fait de notre microbiote intestinal l’un de ses terrains d’investigation favoris.
Mille fois plus efficace qu’un antibiotique
« Parmi les centaines de milliards de micro-organismes qui vivent dans notre tube digestif, certains produisent des substances aux propriétés antibiotiques. C’est le cas de la bactérie Ruminococcus gnavus chez laquelle nous avons identifié cinq molécules antimicrobiennes différentes, dont la ruminococcine C1 (RumC1) », détaille le chercheur du LCBM. Depuis quelques années, ce peptide est l’objet de toutes les attentions de Victor Duarte et ses collègues. Après être parvenus à synthétiser la molécule en laboratoire, ils ont cherché à démontrer son pouvoir antibactérien. L’équipe a ainsi constaté que RumC1 était active à faible dose sur plusieurs bactéries impliquées dans des infections nosocomiales et de l’intestin5.
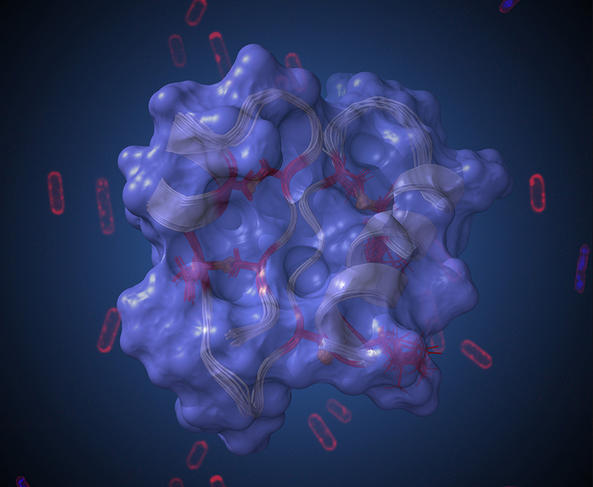
Bien que le mode d’action de RumC1 conserve une part de mystère, les scientifiques savent qu’il diffère de celui des antibiotiques les plus couramment utilisés. « Alors que les molécules de cette famille neutralisent les micro-organismes pathogènes en créant des trous dans leur membrane, notre peptide pénètre dans la cellule bactérienne pour perturber une ou plusieurs voies de synthèses biologiques comme celles de l’ADN ou des protéines », explique Victor Duarte. Nombre de caractéristiques de RumC1 laissent entrevoir une possible utilisation thérapeutique.
Sa structure très compacte lui confère tout d’abord une grande résistance aux conditions physiologiques et à divers traitements physico-chimiques. Le peptide ne présente en outre aucune toxicité envers les cellules de l’intestin. Son efficacité a également été mise en évidence chez des souris infectées par une bactérie déclenchant une forme de péritonite intestinale. « La dose de RumC1 permettant d’éliminer le pathogène dans le système digestif des rongeurs s’est révélée mille fois inférieure à celle d’un antibiotique couramment utilisé pour traiter ce genre d’infection », se réjouit Victor Duarte.
À l’heure où l’Organisation mondiale de la santé (OMS) prédit que l’antibiorésistance sera responsable de 10 millions de décès par an à l’horizon 2050, RumC1 offre une alternative prometteuse aux antibiotiques actuels dont l’efficacité ne cesse de décliner.
Une protocellule à base de bactéries
Parvenir à mimer l’ensemble des réactions qui se déroulent dans une cellule vivante constitue la quête de nombreux chimistes et biologistes. Si plusieurs équipes scientifiques sont déjà parvenues à reconstituer certaines fonctions cellulaires essentielles, comme des cascades enzymatiques ou la synthèse d’ARN et de protéines à partir d’ADN, les intégrer au sein d’un même compartiment se révèle bien plus ardu. Des chercheurs de l’université de Bristol, en collaboration avec un chimiste du Centre de recherche Paul Pascal6 (CRPP) de Bordeaux sont toutefois parvenus à relever ce défi en intégrant des micro-organismes dans des microgouttelettes de polymères7. « Nous n’avons fait qu’appliquer le précepte du célèbre médecin allemand Rudolf Virchow (1821-1902, Ndlr) selon lequel “Toute cellule provient d’une autre cellule” », résume Nicolas Martin, chargé de recherche CNRS au CRPP.
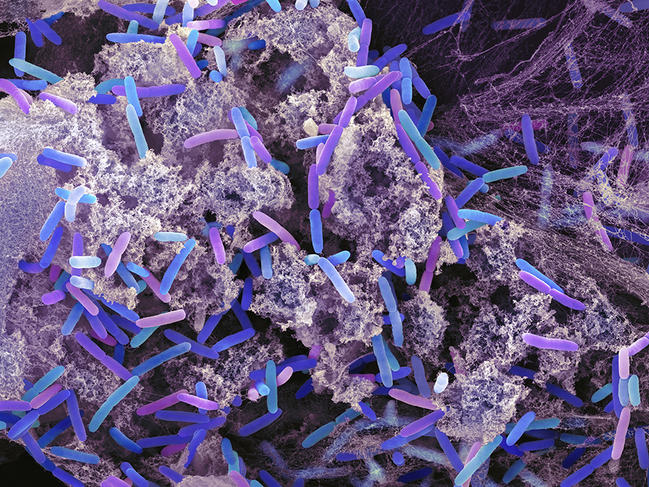
La stratégie dite « Bottom-up », mise en œuvre pour construire cette cellule artificielle n’en demeure pas moins avant-gardiste. Elle consiste à extraire d’organismes vivants, Escherichia coli (E. coli) et Pseudomonas aeruginosa en l’occurrence, les briques capables d’assurer le fonctionnement de n’importe quelle unité cellulaire. Une fois emprisonnées dans la microgouttelette qui fait office de cytoplasme, les bactéries sont détruites à l’aide de produits chimiques pour qu’elles puissent libérer leurs composants cellulaires (on parle de lyse cellulaire) : ADN, protéines, lipides, etc.
Afin de constituer un ersatz de noyau, l’ADN bactérien est ensuite concentré au sein de la microgouttelette en y ajoutant des histones, protéines basiques associées à l’ADN des chromosomes. À ce stade, il ne reste plus qu’à assurer l’autonomie énergétique de cette protocellule. Pour cela, des bactéries E. coli sont une nouvelle fois mises à contribution. Implantées après l’opération de lyse cellulaire, afin de les maintenir vivantes, ces bactéries tiennent lieu de mitochondries. En induisant la formation d’un cytosquelette protéique au sein de leur protocellule, les chercheurs sont même parvenus à lui faire adopter une morphologie semblable à celle d’une cellule eucaryote
Bien que cette recherche demeure encore très fondamentale, elle augure de possibles applications dans le domaine de la santé. « De telles cellules artificielles pourraient être mises à contribution pour synthétiser des médicaments ou se substituer aux cellules défaillantes dans certains organes », illustre Nicolas Martin.
Un micro-organisme au pouvoir magnétique
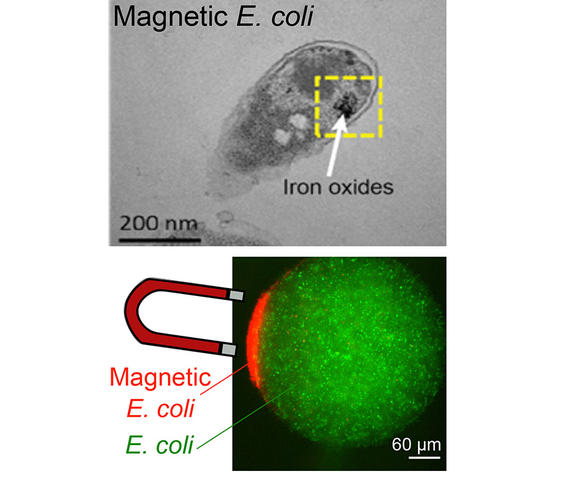
Comme leur nom le laisse deviner, les bactéries magnétotactiques utilisent le champ magnétique terrestre pour s’orienter et se déplacer. Une capacité que ces micro-organismes doivent à la présence d’organites intracellulaires qui se comportent comme des aimants : les magnétosomes. Un consortium réunissant des chercheurs de plusieurs laboratoires français8 s’est inspiré de ce phénomène pour concevoir une bactérie magnétique. La première étape de ce travail9 a consisté à modifier génétiquement la bactérie E. coli pour qu’elle produise de la ferritine. Cette protéine qui s’apparente à une cage de dimension nanométrique permet de stocker le fer à l’intérieur de la bactérie. Dans un second temps, du fer sous forme de sels métalliques est ajouté dans le milieu de culture des bactéries.
« Après avoir été capturé par le micro-organisme, le métal s’oxyde pour former une nanoparticule qui lui confère des propriétés magnétiques tout en le protégeant d’un excès de fer qui lui serait fatal », souligne Zoher Gueroui, directeur de recherche au CNRS, au laboratoire Pasteur10 de Paris ayant dirigé ces investigations. Une fois modifié, le micro-organisme peut être contrôlé très facilement à l’aide de simples aimants. Parmi les pistes d’application déjà explorées par les chercheurs figure la possibilité d’utiliser cette bactérie magnétique en tant que biocapteur.
Le principe, qui a fait l’objet d’un dépôt de brevet, est le suivant : en réponse à la signature biochimique d’un agent pathogène, la bactérie magnétique émet un signal fluorescent. « En appliquant un champ magnétique, il est alors possible de concentrer le signal lumineux émanant de chaque bactérie et se faisant d’améliorer très nettement la sensibilité de la mesure »,
complète Zoher Gueroui. En offrant l’opportunité de détecter une infection à un stade précoce, cette méthode pourrait par exemple aider au diagnostic précoce de maladies infectieuses.
Les recherches sur les bactéries sont porteuses de nombreuses autres innovations dans le domaine des biocapteurs. L’une d’elle pourrait révolutionner l’analyse des taux d’hormones. Fruit d’une collaboration franco-américaine incluant des chercheurs du Laboratoire de chimie des polymères organiques11, ce travail a permis de concevoir un biocapteur de progestérone à partir de facteurs de transcription bactériens. Contrairement aux biocapteurs hormonaux actuels, qui ne permettent pas de mesurer les fluctuations de concentration de ces substances, cette solution est à même d’offrir une lecture en continu du niveau de progestérone.
En modifiant la structure moléculaire d’un récepteur qu’une bactérie utilise pour se fixer aux cellules humaines, une équipe franco-autrichienne12 a pour sa part réussi à le rendre spécifique à certains groupes sanguins. Ce premier pas vers le développement de biocapteurs programmables laisse entrevoir un large éventail d’applications autour du diagnostic médical.
Notes :
1. « The biomass distribution on Earth », Yinon M. Bar-On et al., PNAS, mai 2018. https://doi.org/10.1073/pnas.1711842115(link is external)
2. Unité CNRS/CEA/Université Grenoble Alpes.
3. Unité CNRS/École centrale de Marseille/Aix-Marseille Université.
4. Fédération de recherche CNRS/Aix-Marseille Université.
5. « The unusual structure of Ruminococcin C1 antimicrobial peptide confers clinical properties », Clarisse Roblin et al., PNAS, juillet 2020. https://doi.org/10.1073/pnas.2004045117(link is external)
6. Unité CNRS/Université de Bordeaux.
7. « Living material assembly of bacteriogenic protocells »(link is external), Can Xu et al., Nature, septembre 2022.
8. Laboratoire Pasteur (CNRS/ENS-PSL/Sorbonne Université), Institut de minéralogie, de physique des matériaux et de cosmochimie (CNRS/MNHN/Sorbonne Université), Institut de biologie de l’ENS (CNRS/ENS-PSL/Inserm), Centre interdisciplinaire de recherche en biologie (CNRS/Collège de France/Inserm).
9. « Engineering E. coli for magnetic control and the spatial localization of functions »(link is external), Mary Aubry et al., ACS Synthetic Biology, septembre 2020.
10. Pour Processus d’activation sélectif par transfert d’énergie uni-électronique ou radiatif (CNRS/ENS-PSL/Sorbonne Université).
11. Unité CNRS/Bordeaux INP/Université de Bordeaux.
12. Centre de recherches sur les macromolécules végétales (CNRS) et Centre de biotechnologie industrielle autrichien.
Photo 1 : Plusieurs centaines de milliards de micro-organismes vivent dans notre tube digestif (ici l’intestin). © Tatiana Shepeleva /Stock.Adobe.com
Photo 2 : Issu d’une bactérie présente dans notre tube digestif, le peptide RumC1 est une nouvelle arme efficace contre des pathogènes résistants aux antibiotiques les plus courants. © Clarisse Roblin, Matthieu Nouailler
Photo 3 : Un autre espoir pour lutter contre l’antibiorésistance serait de construire une cellule artificielle à partir de « Pseudomonas aeruginosa » (ici vue au microscope éléctronique à balayage et colorisée), bactérie en forme de bâtonnet qui se trouve entre autres dans la flore normale de l’intestin humain. © Science Photo Library
Photo 4 : En haut, des nanoparticules d’oxyde de fer au sein de bactéries « Escherichia coli », vues en microscopie électronique ; en bas, image par microscopie optique de l’accumulation de bactéries magnétiques exprimant des protéines fluorescentes rouges attirées par un aimant. Ces travaux ont pour but de créer de nouveaux outils de diagnostic. © Aubry et al.
